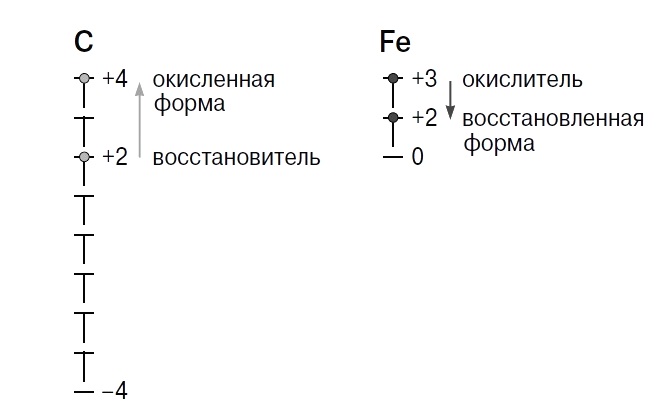
Что делает восстановитель и окислитель
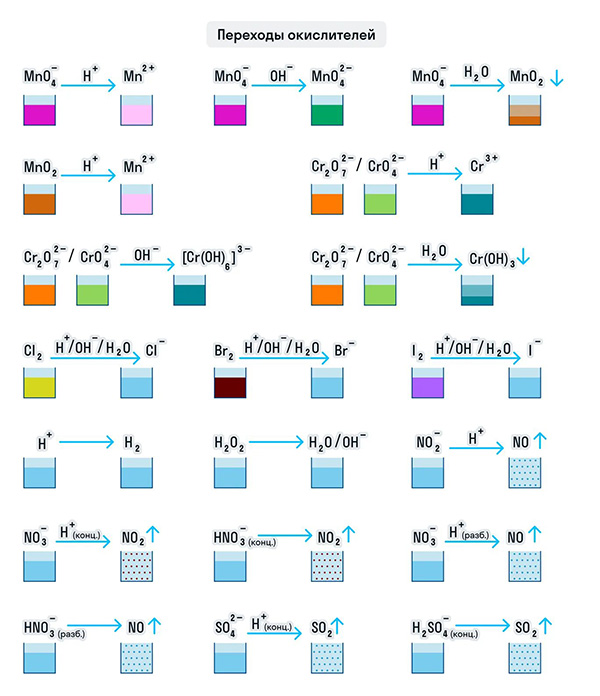
МЕТОД ЭЛЕКТРОННО-ИОННОГО БАЛАНСА (МЕТОД ПОЛУРЕАЦИЙ)
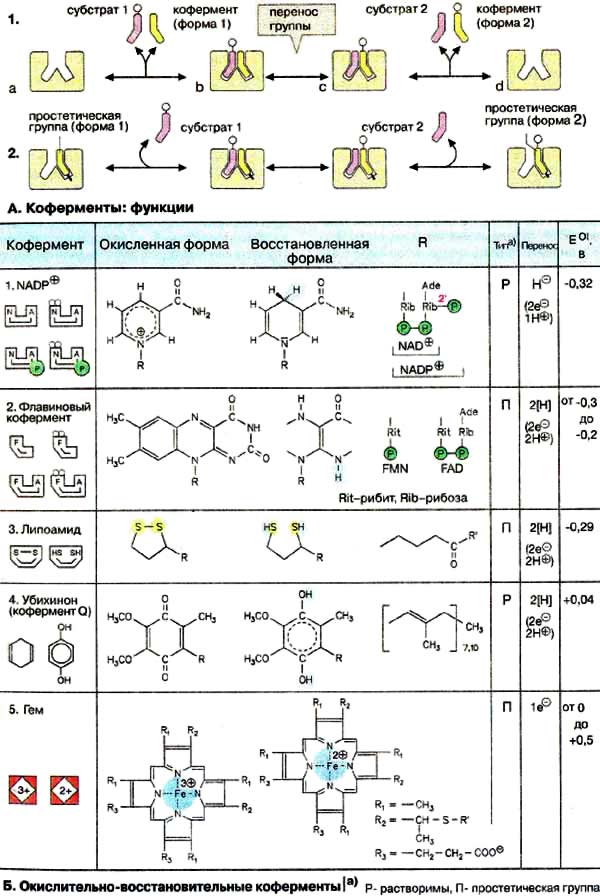
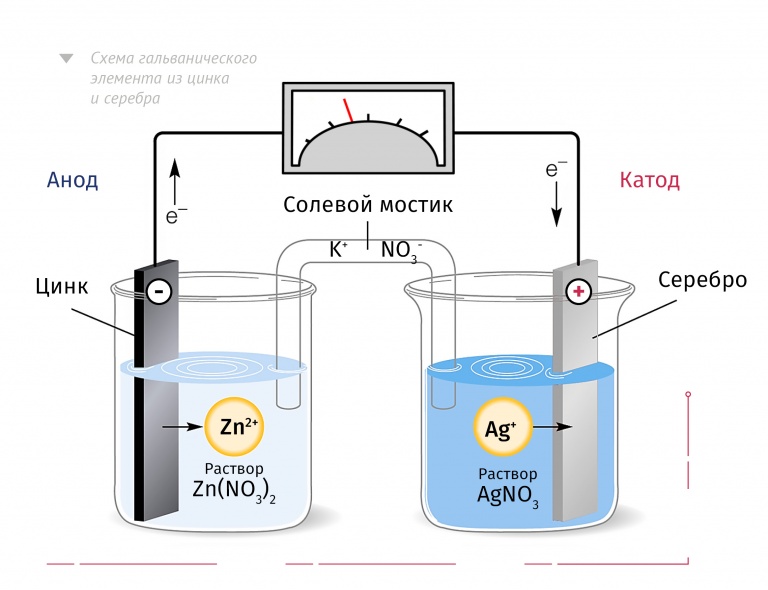
Окислительно-восстановительные реакции — это реакции, в которых происходит изменение степени окисления конкретных элементов, входящих в состав реагирующих друг с другом химических веществ. Это объясняется тем, что атомы способны обмениваться электронами друг с другом. Процесс окисления всегда происходит одновременно с восстановлением. Реакции отдачи и захвата электронов атомами записываются в виде полууравнений. Окислительно-восстановительные реакции играют важную роль в нашей жизни и протекают во многих процессах, таких как фотосинтез или коррозия металлов.

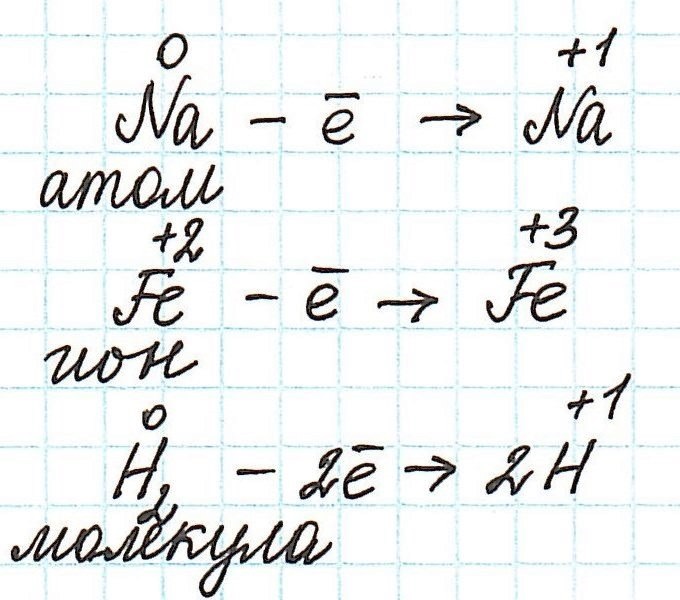



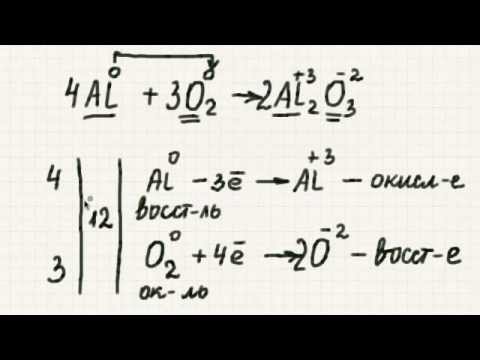

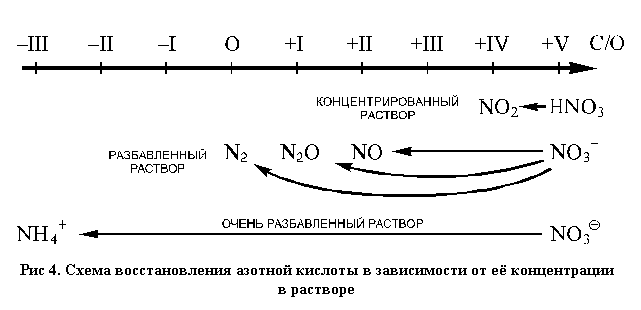
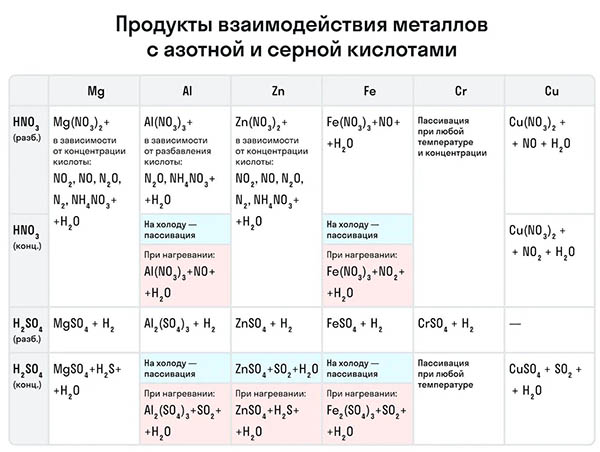
Для расстановки коэффициентов в ОВР используют различные методы, среди которых наиболее часто применяют метод электронного баланса и метод полуреакций. В основе методов расстановки коэффициентов в ОВР лежит правило:. Общее число электронов, отданных восстановителем, должно быть равно общему числу электронов, принятых окислителем. Метод электронного баланса. Рассмотрим метод электронного баланса на примере реакции взаимодействия меди с разбавленной азотной кислотой. Для расстановки коэффициентов методом электронного баланса можно придерживаться следующего алгоритма.





_3.jpg)





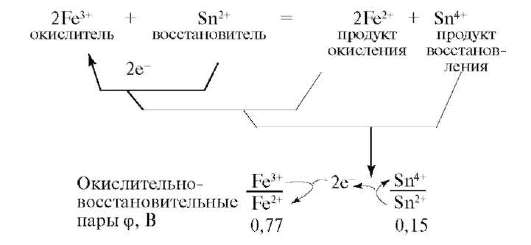
Окислительно-восстановительные реакции ОВР — это реакции, при протекании которых происходит изменение степени окисления химических элементов, входящих в состав реагентов. Степень окисления — условный формальный заряд атома в химическом соединении, который находят, считая химические связи в соединении чисто ионными. Окисление потеря электронов, то есть повышение степени окисления.